近日,《美国化学会催化(ACS Catalysis)》期刊发表了betway必威邓子新院士团队孙宇辉教授课题组、英国剑桥大学和巴西圣保罗大学关于庆大霉素双脱氧催化机制的最新合作研究成果。在这一题为“Mechanistic Insights into Dideoxygenation in Gentamicin Biosynthesis”研究论文中,通过遗传学、生物化学和结构生物学等多学科研究方法,成功揭示了庆大霉素生物合成中双脱氧修饰的过程和催化机理,完成了曾经抗感染明星药物庆大霉素复杂生物合成途径的最后一块“拼图”。这也是孙宇辉教授课题组十余年来,聚焦于庆大霉素生物合成机制系列研究成果的最新突破(Chem Biol, 2014; Chem Biol, 2015; PNAS, 2018; ACS Catal, 2021)。
庆大霉素作为氨基糖苷类抗生素的经典代表,曾一度是治疗革兰氏阴性细菌感染的首选药物。但伴随着日益严重的抗生素耐药性问题,以及庆大霉素自身的肾毒性和耳毒性,如何通过合成生物学方法研制出更为高效和更为安全的庆大霉素等新型氨基糖苷类药物,已成为人们的迫切愿望。为此,对其生物合成途径彻底清晰的阐明,尤其是对赋予了庆大霉素对抗部分钝化酶特性的C-3’和C-4’的双脱氧分子结构的形成机制,是对其进行理性改造的重要基础与前提,也一直吸引着人们好奇和探索的目光。
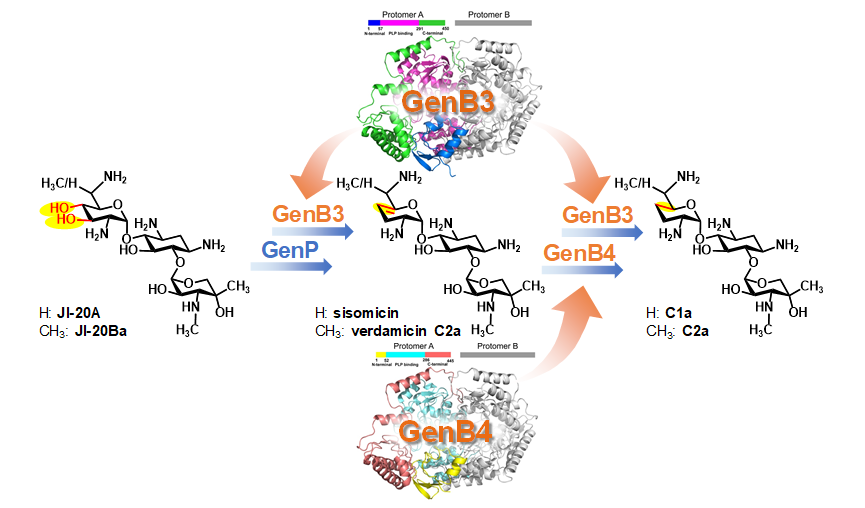
在前期系统研究积累的基础上,课题组通过对可能涉及双脱氧的PLP依赖的转氨酶候选编码基因进行体内遗传敲除,证实了GenB3和GenB4参与该过程,并通过鉴定的数个中间产物,说明该过程实际上包括连续的脱双羟基和双键还原步骤。再经GenB3和GenB4的重组表达,并以分离获得的中间产物为底物进行严格的体外生化验证。发现脱双羟基并非单一的反应,除了磷酸化酶GenP负责的中间体磷酸化之外,它包含了连续的脱磷酸、异构化、脱氨基和转氨过程,而这些复杂的变化均由GenB3单独催化完成。另一方面,GenB4主导的双键还原并未使用还原型辅酶,而是非常规地通过亚氨基水解,间接地实现了还原,再通过GenB3转氨,得到最终庆大霉素C组分产物。这个过程也因为不同寻常的还原方式,在同一位点反复脱氨或转氨多达四次。整个催化过程简单的表象之下却蕴藏着自然界天然产物独特而精彩的催化机理。此外,还令人惊讶地发现,GenB3和GenB4虽然氨基酸序列极其相似,但功能却不尽相同。通过对其蛋白晶体的结构解析,表明GenB3中第57位的Ser和GenB4中第52位Asp可能是引发其功能不同的关键所在,即仅仅一个氨基酸位点的不同,最终决定了两者功能的巨大差异。
必威betway中文版李思聪、圣保罗大学Priscila Dos Santos Bury以及剑桥大学的黄方吕为本文并列第一作者,本研究得到国家重点研发计划和国家自然科学基金国际(地区)合作与交流重点项目的资助。